尊龙凯时致力于生物医疗前沿技术的研发,其中一项新兴的治疗策略是靶向蛋白质降解,旨在选择性地消除细胞中的特定蛋白质。虽然最初研究主要集中于PROTAC分子,但现在逐渐涌现出多种新的靶向降解方法。其中,降解TAG(dTAG)技术脱颖而出,成为一种创新的靶标验证方法。与PROTACs相似,dTAG通过一种异双功能小分子构建目标蛋白质和E3泛素连接酶之间的三元复合物。
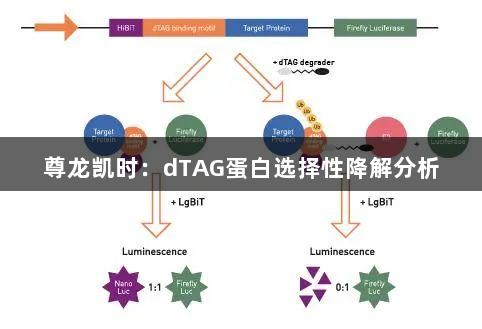
dTAG技术的独特之处在于,它利用CRISPR/Cas9技术在目标蛋白中人工引入双功能降解剂的一部分结合位点,从而使dTAG成为靶标验证和剂量依赖效应研究的理想工具。本文将介绍使用双荧光素酶报告系统来测量靶蛋白降解的dTAG蛋白降解分析。我们选择萤火虫荧光素酶作为基准标记物,确保其不受dTAG降解的影响;另一种荧光素酶则是纳米荧光素酶(Nanoluciferase),它以非活性形式(HiBiT)与靶蛋白融合。
dTAG降解剂通过引入的dTAG结合位序将靶蛋白与E3泛素连接酶连接,从而形成三元复合体。这一过程导致靶蛋白及其融合的HiBiT片段的泛素化和降解。为测量纳米荧光素酶的发光,在降解后加入LgBiT,完成未降解的HiBiT片段,从而产生可检测的荧光信号。相比萤火虫荧光素酶的发射,纳米荧光素酶的发射比值则反映了dTAG降解剂的效能,比值越低,表示目标降解的程度越高。
研究目标
本研究旨在通过改进已有的dTAG结构,优化其动力学参数。为此,研究人员将dTAG降解剂或DMSO对照物分配在1536孔的iSTAR微孔板中。随后,将稳定转染的pSBTK-HiBiT-dTAG-TargetX-P2A-Fluc-T2A-Puro质粒的HEK293细胞制成细胞悬液,在包含2% fetal bovine serum (FBS) 的OPTIMEM培养基中重悬,并加入每孔25µL的细胞悬液。微孔板在5% CO2、37°C环境下孵育4小时以促进细胞生长。
经过每孔加入OneGlo试剂并孵育后,使用荧光酶标仪读取萤火虫荧光素酶的发光信号。进一步添加StopGlo试剂、纳米荧光素酶底物和LgBiT后,再次读取纳米荧光素酶的化学发光。接着,评估多种dTAG降解剂在诱导HiBiT靶向降解方面的能力,各种dTAG分子表现出浓度依赖性,其中dTAG-13和dTAG-v1分别显示出不同程度的靶向降解效果。
结果与讨论
在评估dTAG-v1降解剂的实验中,在1至10µM的浓度范围内,结果显示出良好的重复性和数据稳定性。dTAG-v1表现出显著的HiBiT融合蛋白降解效果,其效果与DMSO对照组相比,其信号与空白比值(S/B值)显示一致性的下降,Z因子在0.84至0.87的范围内,表明数据的可靠性。
结论
通过dTAG蛋白质降解检测,测试的dTAG分子成功诱导了HiBiT融合蛋白的靶向降解。借助尊龙凯时的高灵敏度荧光酶标仪PHERAstarFSX,结合iSTAR板的使用,展现出卓越的实验表现,为未来的生物医疗研究提供了新的可能性。


